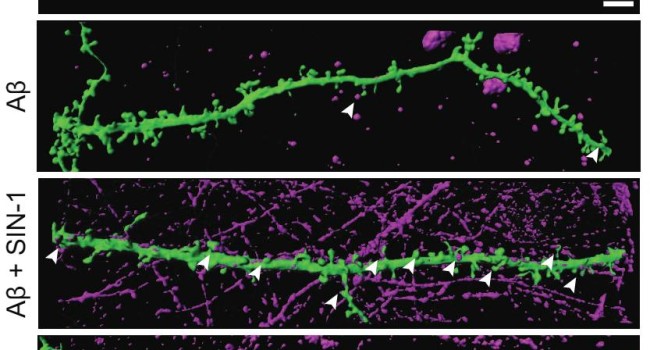
Durante los últimos veinte años, los estudios de investigación han señalado la acumulación de agregados de proteína beta-amiloide (Aβ) como el suceso principal en el origen del alzhéimer. Ahora, un estudio liderado por Francisco José Muñoz, investigador principal en el Departamento de Ciencias Experimentales y de la Salud (DCEXS) de la Universidad Pompeu Fabra (UPF), arroja luz sobre la acumulación de estos agregados en el cerebro, descubriendo que la presencia de peroxinitrito en el ambiente extracelular promueve la formación y la estabilización de los agregados de beta-amiloide.
El beta-amiloide es una proteína presente en el sistema nervioso cuya función no se conoce con exactitud. Las formas solubles de beta-amiloide pueden agregar dando lugar a unas estructuras primarias llamadas oligómeros, que a su vez se agregan para dar lugar a las fibras maduras. Algunos expertos consideran que la formación de fibras maduras es un mecanismo protector para evitar la presencia de oligómeros, puesto que éstos se han descrito como la forma más tóxica de beta-amiloide. Los oligómeros alteran directamente la función de las neuronas y promueven la neurodegeneración.
Los oligómeros y las fibras de beta-amiloide incrementan la producción de óxido nítrico y de radicales libres en el ambiente extracelular. Cuando éstos se combinan, se produce peroxinitrito, una molécula altamente reactiva que modifica las proteínas, alterando su función. El estudio liderado por Francisco José Muñoz revela que cuando el peroxinitrito reacciona con los oligómeros de beta-amiloide, facilita su estabilización e impide la formación de las fibras maduras. De esta manera, cuanta más proteína beta-amiloide hay, más se promueve la formación de peroxinitrito y éste, a su vez, hace que los oligómeros de beta-amiloide se mantengan estabilizados, perpetuando el daño a nivel neuronal característico de la enfermedad de Alzheimer.
“El estudio de los mecanismos que subyacen a la agregación de beta-amiloide es crucial para el desarrollo de nuevas estrategias terapéuticas”, comenta Francisco José Muñoz. Además de describir los efectos que tiene la nitración sobre los oligómeros de beta-amiloide, el equipo científico en colaboración con los investigadores Baldo Oliva y David Andreu ha desarrollado un modelo computacional según el cual una mutación de la adición del grupo nitro a la proteína beta-amiloide estabiliza los altamente tóxicos oligómeros de beta-amiloide e impide la formación de fibras maduras. “Es esencial conocer en profundidad los mecanismos moleculares que ocurren en los inicios de la enfermedad, cuando todavía no se presentan síntomas, para poder desarrollar terapias focalizadas en la prevención y el tratamiento precoz”, comenta la autora del artículo, Biuse Guivernau.